Class 11 Chemistry Chapter 1 Notes in Hindi PDF
Class 11 Chemistry Chapter 1 Notes in Hindi | Class 11 Chemistry Handwritten Notes in Hindi PDF | Class 11 Chemistry NCERT Solutions Hindi Medium | Chapter 1 Some Basic Concepts of Chemistry.
Class 11 Chemistry Chapter 1 Notes in Hindi: यदि आप कक्षा XI रसायन विज्ञान के नोट्स कि तलाश में हैं, तो आपको बता दे कि आप सही जगह पर आ गए हैं। आपको यहा Class 11 Chemistry Chapter 1 Notes in Hindi PDF को FREE में कैसे Download करें उसके बारे मे बताया जायेगा।
यह Class 11 Chemistry Chapter 1 Notes आपके लिए डिज़ाइन किए गए हैं। कक्षा XI Chemistry Chapter 1 Notes बुद्धिमान शिक्षकों द्वारा तैयार किए गए हैं, जो कक्षा XI परीक्षाओं के लिए महत्वपूर्ण हैं और आपको बता दे के Class 11 Chemistry Notes in Hindi पिछले कई वर्षों की परीक्षाओं के आधार पर बनाया गए है ।
Class 11 Chemistry Chapter 1 Notes in Hindi बोर्ड परीक्षा में अच्छे नम्बर प्राप्त करने में मदद करेंगे। Class 11th Chemistry Notes in Hindi PDF एक बहुत ही Interesting Subject है। यदि आप कक्षा 11th के रसायन विज्ञान के इन सभी नोट्स का अध्ययन करना चाहते हैं तो नीचे दिये गये Direct Link पर Click करके आप बहुत ही आसानी से इन सभी Class 11 Chemistry Chapter 1 Notes in Hindi PDF Files को डाउनलोड कर सकते हैं ।
Class 11 Chemistry Notes in Hindi PDF Download
Class 11 Chemistry Chapter 1 Notes PDF Download: 11th Chemistry Notes in Hindi Medium, क्लास 11th रसायन विज्ञान नोट्स डाउनलोड पीडीएफ, NCERT Book for Class 11th Chemistry PDF in Hindi, Class 11th Chemistry NCERT book pdf download in Hindi, Class 11 Chemistry Handwritten Notes in hindi pdf.
- अध्याय 1:- रसायन विज्ञान की कुछ मूल अवधारणाएँ
- अध्याय 2:- परमाणु की संरचना
- अध्याय 3:- तत्वों का वर्गीकरण एवं गुणधर्मों में आवर्तिता
- अध्याय 4:- रासायनिक आबंधन तथा आण्विक संरचना
- अध्याय 5:- द्रव्य के अवस्थाएँ तथा ठोस अवस्था
- अध्याय 6:- उष्मागतिकी
- अध्याय 7:- साम्यावस्था
- अध्याय 8:- अपचयोपचय अभिक्रियाएँ
- अध्याय 9:- हाइड्रोजन
- अध्याय 10:- S – बलॉक तत्व
- अध्याय 11:- P – बलॉक तत्व I & II
- अध्याय 12:- कार्बनिक रसायन: कुछ आधारभूत सिद्धांत तथा तकनीकें
- अध्याय 13:- हाइड्रोकार्बन
- अध्याय 14:- पर्यावरणीय रसायन
Class 11 Chemistry Chapter 1 Notes
NCRT Class 11 Chemistry Chapter 1 Notes: रसायन विज्ञान नोट्स की कुछ बुनियादी अवधारणाओं को लगभग 20 वर्षों के अनुभव वाले शिक्षकों द्वारा और पिछले दस वर्षों के परीक्षा पत्रों का अध्ययन करने के बाद बड़े पैमाने पर संकलित किया गया है। इसके अलावा, वे सभी नवीनतम शैक्षणिक वर्ष की विषय सामग्री के साथ डिज़ाइन किए गए हैं ताकि Class 11th Syllabus में किसी भी अंतर का भी हिसाब लगाया जा सके।
Some Basic Concepts of Chemistry Class 11 Questions and Answers Pdf
some basic concepts of chemistry class 11 questions and answers pdf बहुत उपयोगी और महत्वपूर्ण हैं, क्योंकि यह आवश्यक है कि सभी प्रश्नों का उत्तर कुशल तरीके से दिया जाए। इन Chapter 1 Some Basic Concepts of Chemistry से कक्षा 12 के लिए रसायन विज्ञान नोट्स की कुछ बुनियादी अवधारणाओं का अध्ययन करके और sample papers को नियोजित करके, छात्रों को परीक्षा से पहले किसी भी तनाव को कम करने में कोई कठिनाई नहीं होगी क्योंकि वे अपनी बोर्ड परीक्षा के लिए पहले से पूरी तरह से तैयार होंगे।
इसके अलावा, NCERT रसायन विज्ञान अध्याय 1 कक्षा 12 के लिए रसायन विज्ञान के नोट्स की कुछ बुनियादी अवधारणाओं को पढ़ना आसान है और इसमें सभी अध्ययन सामग्री शामिल हैं, सभी स्पष्ट रूप से वर्णित और संक्षिप्त तरीके से। छात्र Class 11 Chemistry Chapter 1 Notes की कुछ बुनियादी अवधारणाओं के साथ-साथ कक्षा 12 के लिए सेल्फ स्टडीज द्वारा प्रदान किए गए Sample Paper का भी उपयोग कर सकते हैं। साथ में, छात्रों को subjective और objective जैसे हर प्रकार के प्रश्नों का उत्तर देने के लिए तैयार किया जाएगा |
Chapter 1 Some Basic Concepts of Chemistry
CBSE भारत में बड़ा शैक्षिक बोर्ड है और NCERT उसी के लिए Syllabus आयोजित करता है। NCERT Class 11 Chemistry Chapter 1 Some Basic Concepts of Chemistry Notes अध्ययन सामग्री के सबसे अच्छे भाग में से एक है जो छात्रों को मिल सकता है क्योंकि यह उन्हें बेहतर अध्ययन करने में मदद करेगा और कुछ तनाव को कम करेगा जो कि आने वाले वर्ष के दौरान उन्हें सामना करना पड़ सकता है।Self Study’s chapter-wise Chemistry Chapter 1 प्रदान करता है CBSE बोर्ड परीक्षा के लिए संक्षिप्त की नोट्स को समझने में आसान और Free Download करने योग्य PDF प्रारूप भी है ताकि छात्र अपनी पढ़ाई के लिए इसका अभ्यास कर सकें और अपने में अच्छे अंक प्राप्त कर सकें।
Importance of Chemistry (रसायन विज्ञान का महत्व )
रसायन विज्ञान (मिस्र के शब्द kēme (रसायन) से लिया गया है, जिसका अर्थ है “पृथ्वी”) एक विज्ञान है जो पदार्थ की संरचना, संरचना और गुणों और रासायनिक प्रतिक्रियाओं के दौरान होने वाले परिवर्तनों का अध्ययन करता है। रसायन विज्ञान को अक्सर मुख्य विज्ञान के रूप में संदर्भित किया जाता है क्योंकि यह भौतिक विज्ञान (रसायन विज्ञान सहित) को जीवन विज्ञान और अनुप्रयुक्त विज्ञान (जैसे चिकित्सा और इंजीनियरिंग) के साथ जोड़ने में एक भूमिका निभाता है।
रसायन विज्ञान का हमारे जीवन पर सीधा प्रभाव पड़ता है और विभिन्न क्षेत्रों में अनुप्रयोगों की एक विस्तृत श्रृंखला होती है। ये नीचे दिए गए हैं:
A). In Agriculture and Food: Class 11 Chemistry Chapter 1 Notes in Hindi
- इसने यूरिया, कैल्शियम फॉस्फेट, सोडियम नाइट्रेट, अमोनियम फॉस्फेट आदि रासायनिक उर्वरक प्रदान किए हैं।
- कुछ प्रभावी कीटनाशकों, फफूंदनाशकों और कीटनाशकों के उपयोग से फसलों को कीड़ों और हानिकारक जीवाणुओं से बचाने में मदद मिली है।
- परिरक्षकों के उपयोग से खाद्य उत्पादों जैसे जैम, मक्खन, स्क्वैश आदि को अधिक समय तक संरक्षित रखने में मदद मिली है।
2). In Health and Sanitation: Class 11 Chemistry Chapter 1 Notes in Hindi
- इसने मानव जाति को बड़ी संख्या में जीवनरक्षक दवाएं प्रदान की हैं। आज, सल्फा दवाओं और पेनिसिलिन जीवन रक्षक दवाओं की खोज के कारण पेचिश और निमोनिया का इलाज होता है। सिस्प्लैटिन और टैक्सोल कैंसर चिकित्सा के लिए बहुत प्रभावी पाए गए हैं और एड्स पीड़ितों के लिए AZT (Azidothymidine) का उपयोग किया जाता है।
- नालियों जैसे शौचालय, फर्श आदि में मौजूद सूक्ष्म जीवों को मारने के लिए फिनोल का उपयोग किया जाता है।
- क्लोरीन की कम सांद्रता यानि 0.2 से 0.4 भाग प्रति मिलियन (पीपीएम) का उपयोग पानी के नसबंदी के लिए किया जाता है ताकि इसे पीने के लिए उपयुक्त बनाया जा सके
3). Saving the Environment: Class 11 Chemistry Chapter 1 Notes in Hindi
- पूरी दुनिया में तेजी से हो रहे औद्योगिकीकरण के परिणामस्वरूप बहुत प्रदूषण हुआ है।
- वायुमंडल में जहरीली गैसों और रसायनों को लगातार छोड़ा जा रहा है।
- वे खतरनाक दर पर पर्यावरण को प्रदूषित कर रहे हैं। वैज्ञानिक विकल्प विकसित करने के लिए दिन-रात काम कर रहे हैं जिससे कम प्रदूषण हो सकता है।
- उदाहरण के लिए, CNG (संपीड़ित प्राकृतिक गैस), पेट्रोल का एक विकल्प है, जो ऑटोमोबाइल के कारण होने वाले प्रदूषण की जाँच करने में बहुत प्रभावी है।
4). Application in Industry: Class 11 Chemistry Chapter 1 Notes in Hindi
रसायन विज्ञान ने कई औद्योगिक रूप से विकसित होने में महत्वपूर्ण भूमिका निभाई है, निर्मित उर्वरक, क्षार, एसिड, लवण, रंजक, पॉलिमर, ड्रग्स, साबुन, नई सामग्री सहित डिटर्जेंट, धातु मिश्र धातु और अन्य अकार्बनिक और कार्बनिक रसायन राष्ट्रीय अर्थव्यवस्था में बड़े पैमाने पर योगदान करते हैं।
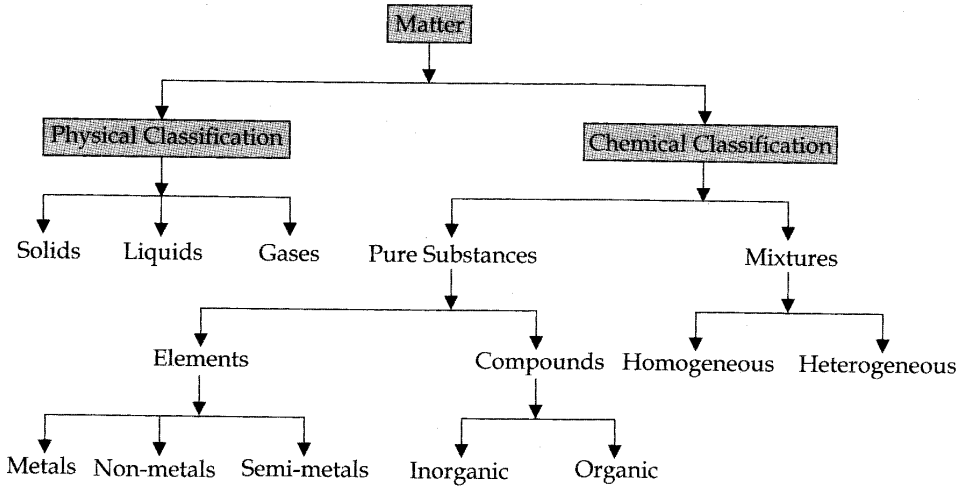
Matter (पदार्थ)
कोई भी वस्तु जिसका द्रव्यमान हो और जो स्थान घेरती हो, द्रव्य कहलाती है। उदाहरण के लिए, पुस्तक, पेंसिल, पानी, वायु पदार्थ से बने होते हैं क्योंकि हम जानते हैं कि उनका द्रव्यमान होता है और वे स्थान घेरते हैं।
• Classification of Matter (पदार्थ का वर्गीकरण )
(A) Physical Classification (भौतिक वर्गीकरण)
(B) Chemical classification (रासायनिक वर्गीकरण)
(A) भौतिक वर्गीकरण: पदार्थ तीन भौतिक अवस्थाओं में मौजूद हो सकता है:
1. ठोस 2. तरल पदार्थ 3. गैसें
1. ठोस: कणों को एक व्यवस्थित तरीके से एक दूसरे के बहुत करीब रखा जाता है और आंदोलन की अधिक स्वतंत्रता नहीं होती है।
ठोसों के लक्षण : ठोस का निश्चित आयतन और निश्चित आकार होता है।
2. तरल पदार्थ: तरल पदार्थों में, कण एक दूसरे के करीब होते हैं लेकिन घूम सकते हैं। द्रवों के अभिलक्षण : द्रवों का आयतन निश्चित होता है लेकिन आकार निश्चित नहीं होता।
3. गैसें: गैसों में, कण ठोस या तरल अवस्था में मौजूद कणों की तुलना में बहुत दूर होते हैं। उनका आंदोलन आसान और तेज है।
गैसों के लक्षण: गैसों का न तो निश्चित आयतन होता है और न ही निश्चित आकार। वे उस कंटेनर पर पूरी तरह से कब्जा कर लेते हैं जिसमें उन्हें रखा जाता है।
(B) रासायनिक वर्गीकरण: संरचना के आधार पर, पदार्थ को दो मुख्य प्रकारों में विभाजित किया जा सकता है:
- शुद्ध पदार्थ
- मिश्रण
1. शुद्ध पदार्थ: एक शुद्ध पदार्थ को एक एकल पदार्थ (या पदार्थ) के रूप में परिभाषित किया जा सकता है जिसे साधारण भौतिक तरीकों से अलग नहीं किया जा सकता है। शुद्ध पदार्थों को आगे वर्गीकृत किया जा सकता है – (i) तत्व (ii) यौगिक
(i) तत्व: एक तत्व में केवल एक प्रकार के कण होते हैं। ये कण परमाणु या अणु हो सकते हैं।
उदाहरण के लिए सोडियम, कॉपर, सिल्वर, हाइड्रोजन, ऑक्सीजन आदि तत्वों के कुछ उदाहरण हैं। उन सभी में एक प्रकार के परमाणु होते हैं। हालांकि, विभिन्न तत्वों के परमाणु प्रकृति में भिन्न होते हैं। कुछ तत्व जैसे सोडियम। या तांबे में एकल परमाणु होते हैं जो उनके घटक कणों के रूप में एक साथ होते हैं जबकि कुछ अन्य में दो या दो से अधिक परमाणु मिलकर तत्व के अणु देते हैं। इस प्रकार, हाइड्रोजन, नाइट्रोजन और ऑक्सीजन गैसों में अणु होते हैं जिनमें दो परमाणु मिलकर तत्व के संबंधित अणु देते हैं।
(ii) यौगिक: इसे एक शुद्ध पदार्थ के रूप में परिभाषित किया जा सकता है जिसमें दो या दो से अधिक तत्व वजन के एक निश्चित अनुपात में एक साथ संयुक्त होते हैं और उपयुक्त रासायनिक विधियों द्वारा इन तत्वों में विघटित हो सकते हैं। इसके अलावा, एक यौगिक के गुण गठन तत्वों से पूरी तरह से भिन्न होते हैं। यौगिकों को दो प्रकारों में वर्गीकृत किया गया है। ये हैं:-
(a) अकार्बनिक यौगिक: ये ऐसे यौगिक हैं जो निर्जीव स्रोतों जैसे चट्टानों और खनिजों से प्राप्त होते हैं। कुछ उदाहरण हैं: सामान्य नमक, मार्बल, जिप्सम, वाशिंग सोडा आदि।
(b) कार्बनिक यौगिक वे यौगिक हैं जो पौधों और जानवरों में मौजूद होते हैं। सभी कार्बनिक यौगिकों में कार्बन उनके आवश्यक घटक के रूप में पाया गया है। उदाहरण के लिए, कार्बोहाइड्रेट, प्रोटीन, तेल, वसा आदि।
2. मिश्रण: दो या दो से अधिक तत्वों या यौगिकों का संयोजन जो रासायनिक रूप से एक साथ नहीं होते हैं और किसी भी अनुपात में मौजूद भी हो सकते हैं, मिश्रण कहलाते हैं। मिश्रण के कुछ उदाहरण हैं: दूध, समुद्र का पानी, पेट्रोल, चूने का पानी, पेंट ग्लास, सीमेंट, लकड़ी आदि । मिश्रण के प्रकार: मिश्रण दो प्रकार के होते हैं:-
(i) सजातीय मिश्रण: मिश्रण को सजातीय कहा जाता है यदि यह एक समान संरचना होती है और घटकों के बीच अलगाव की कोई दृश्य सीमा नहीं होती है।
उदाहरण के लिए: पानी में चीनी के घोल के मिश्रण में चीनी के पानी की संरचना समान होती है और सभी भागों में एक जैसी मिठास होती है।
(ii) विषम मिश्रण: एक मिश्रण को विषमांगी कहा जाता है यदि इसकी पूरी संरचना एक समान न हो और विभिन्न घटकों के बीच अलगाव की दृश्य सीमाएँ हों। विषमांगी मिश्रण के विभिन्न घटकों को नग्न आंखों से भी देखा जा सकता है।
उदाहरण के लिए: जब लोहे का बुरादा और सल्फर पाउडर को एक साथ मिलाया जाता है, तो बनने वाला मिश्रण विषमांगी होता है। यह भूरे-पीले रंग का होता है और दो घटक, लोहा और सल्फर, को आसानी से नग्न आंखों से पहचाना जा सकता है।
>> यौगिकों और मिश्रण के बीच अंतर -Class 11 Chemistry Chapter 1 Notes in Hindi PDF
यौगिक
1. एक यौगिक में, दो या दो से अधिक तत्व रासायनिक रूप से संयुक्त होते हैं।
2. एक यौगिक में, तत्व द्रव्यमान के निश्चित अनुपात में मौजूद होते हैं। यह अनुपात नहीं बदल सकता।
3. कंपाउंड हमेशा सजातीय होते हैं यानी, उनकी रचना एक ही होती है।
4 एक यौगिक में, घटकों को भौतिक विधियों द्वारा अलग नहीं किया जा सकता है |
5. एक यौगिक में, घटक अपनी पहचान खो देते हैं, अर्थात, यौगिक बनाने वाले तत्वों की विशेषताओं को नहीं दिखाता है।
मिश्रण
1. मिश्रण में, या अधिक तत्व या यौगिक केवल मिश्रित होते हैं और रासायनिक रूप से संयुक्त नहीं होते हैं।
2. एक मिश्रण में घटक निश्चित अनुपात में मौजूद नहीं होते हैं। यह भिन्न
हो सकता है। 3. मिश्रण या तो सजातीय या विषम प्रकृति के हो सकते हैं।
4. मिश्रण के संघटकों को भौतिक विधियों द्वारा अलग किया जा सकता है।
5, मिश्रण में, घटक अपनी पहचान नहीं खोते हैं, अर्थात मिश्रण सभी घटकों की विशेषताओं को दर्शाता है।
हमने पदार्थ के भौतिक और रासायनिक वर्गीकरण पर चर्चा की है। उसी का एक फ्लो शीट प्रतिनिधित्व नीचे दिया गया है।
• पदार्थ के गुण और उनके माप
भौतिक गुण: वे गुण जिन्हें पदार्थ की पहचान या संरचना को बदले बिना मापा या देखा जा सकता है।
भौतिक गुणों के कुछ उदाहरण रंग, गंध, गलनांक, क्वथनांक आदि हैं। रासायनिक गुण: इसे होने के लिए रासायनिक परिवर्तन की आवश्यकता होती है। रासायनिक गुणों के उदाहरण विभिन्न पदार्थों की विशिष्ट प्रतिक्रियाएं हैं। इनमें अम्लता, क्षारकता, ज्वलनशीलता आदि शामिल हैं।
• मापन कीइकाइयाँ मौलिक इकाइयाँ: द्रव्यमान, लंबाई और समय की मात्राओं को मौलिक मात्रा कहा जाता है और उनकी इकाइयों को मौलिक इकाइयों के रूप में जाना जाता है।
मात्राओं के लिए माप की सात बुनियादी इकाइयाँ हैं: लंबाई, द्रव्यमान, समय, तापमान, पदार्थ की मात्रा, विद्युत प्रवाह और चमकदार तीव्रता।
C-सिस्टम: माप की यह प्रणाली दुनिया भर में कार्यरत सबसे आम प्रणाली है।
इसमें ऊपर सूचीबद्ध सभी सात मूल मात्राओं की इकाइयाँ दी गई हैं।
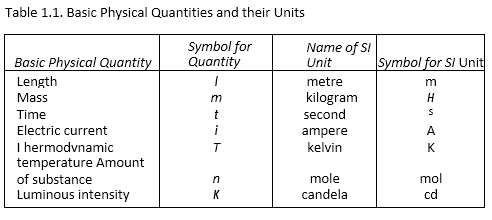
• बुनियादी एसआई इकाइयों की परिभाषा
1. मीटर: यह एक सेकंड के 1/299792458 के समय अंतराल के दौरान निर्वात में प्रकाश द्वारा यात्रा किए गए पथ की लंबाई है।
2. किलोग्राम: यह द्रव्यमान की इकाई है। यह
किलोग्राम के अंतरराष्ट्रीय प्रोटोटाइप के द्रव्यमान के बराबर है । ,
3. दूसरा: यह विकिरण की ९१९२६३१, ७७० अवधि की अवधि है जो सीज़ियम-१३३ परमाणु की जमीनी अवस्था के दो अति सूक्ष्म स्तरों के बीच संक्रमण के अनुरूप है।
4. केल्विन: यह थर्मोडायनामिक तापमान की इकाई है और पानी के त्रिगुण बिंदु के थर्मोडायनामिक तापमान के 1/273.16 के बराबर है।
5. एम्पीयर : एम्पीयर वह नियत धारा है जिसे यदि अनंत लंबाई के नगण्य वृत्ताकार अनुप्रस्थ काट के दो सीधे समानांतर कंडक्टरों में रखा जाए और निर्वात में 1 मीटर की दूरी पर रखा जाए, तो इन कंडक्टरों के बीच 2 x 10-7 के बराबर बल उत्पन्न होगा। एन प्रति मीटर लंबाई।
6. कैंडेला: इसे किसी स्रोत से दी गई दिशा में चमकदार तीव्रता के रूप में परिभाषित किया जा सकता है, जो आवृत्ति 540 x 1012 हर्ट्ज के मोनोक्रोमैटिक विकिरण का उत्सर्जन करता है और जिसकी उस दिशा में 1/683 वाट प्रति स्टेरेडियन की उज्ज्वल तीव्रता होती है।
7. मोल: यह पदार्थ की वह मात्रा है जिसमें उतने ही प्राथमिक तत्व होते हैं जितने कि 0.012 किलोग्राम कार्बन -12 में परमाणु होते हैं। इसका प्रतीक ‘मोल’ है।
• द्रव्यमान और भार
द्रव्यमान: किसी पदार्थ का द्रव्यमान उसमें मौजूद पदार्थ की मात्रा है।
किसी पदार्थ का द्रव्यमान स्थिर होता है।
एक विश्लेषणात्मक
संतुलन का उपयोग करके किसी पदार्थ का द्रव्यमान प्रयोगशाला में सटीक रूप से निर्धारित किया जा सकता है । द्रव्यमान का SI मात्रक किलोग्राम है।
भार: यह किसी वस्तु पर गुरुत्वाकर्षण द्वारा लगाया गया बल है। गुरुत्वाकर्षण में परिवर्तन के कारण पदार्थ का भार एक स्थान से दूसरे स्थान पर भिन्न हो सकता है।
आयतन: आयतन का अर्थ है पदार्थ द्वारा घेरा गया स्थान। इसकी (लंबाई) ३ की इकाइयाँ हैं। SI मात्रकों में आयतन को मीटर3 (m3) में व्यक्त किया जाता है। हालांकि, विशेष रूप से तरल पदार्थ में मात्रा मापने की एक लोकप्रिय इकाई लीटर (एल) है लेकिन यह एसआई इकाइयों या एसआई इकाई में नहीं है।
गणितीय रूप से,
1L = 1000 mL = 1000 cm3 = 1dm3।
द्रवों के आयतन को विभिन्न उपकरणों जैसे ब्यूरेट, पिपेट, सिलेंडर, मापने वाले फ्लास्क आदि द्वारा मापा जा सकता है। उन सभी को अंशांकित किया गया है।

तापमान: तीन पैमाने हैं जिनसे तापमान मापा जा सकता है। इन्हें सेल्सियस स्केल (°C), फारेनहाइट स्केल (°F) और केल्विन स्केल (K) के रूप में जाना जाता है।
-> सेल्सियस पैमाने वाले थर्मामीटरों को 0°C से 100°C तक कैलिब्रेट किया जाता है।
-> फारेनहाइट पैमाने वाले थर्मामीटर को 32°F से 212°F तक कैलिब्रेट किया जाता है।
-> तापमान का केल्विन पैमाना SI पैमाना है और इन दिनों बहुत आम है। इस पैमाने
पर तापमान K के संकेत द्वारा दिखाया गया है। दो पैमानों पर तापमान एक दूसरे से संबंध से संबंधित हैं

घनत्व: किसी पदार्थ का घनत्व उसकी मात्रा है द्रव्यमान प्रति इकाई आयतन। तो, घनत्व की SI इकाई निम्नानुसार प्राप्त की जा सकती है:
यह इकाई काफी बड़ी है और एक रसायनज्ञ अक्सर घनत्व को g cm 3 में व्यक्त करता है जहाँ द्रव्यमान को ग्राम में और आयतन को cm 3 में व्यक्त किया जाता है ।
• माप में अनिश्चितता
सभी वैज्ञानिक मापों में कुछ हद तक त्रुटि या अनिश्चितता शामिल होती है। जो त्रुटियां उत्पन्न होती हैं वे दो कारकों पर निर्भर करती हैं।
(i) कार्यकर्ता का कौशल और सटीकता (ii) माप उपकरणों की सीमाएं।
• वैज्ञानिक संकेतन
यह एक घातांकीय संकेतन है जिसमें किसी भी संख्या को N x 10 n के रूप में दर्शाया जा सकता है जहाँ n धनात्मक या ऋणात्मक मान वाला एक घातांक है और N 1 से 10 के बीच भिन्न हो सकता है। इस प्रकार, 232.508 को 2.32508 x के रूप में लिखा जा सकता है 10 2 वैज्ञानिक संकेतन में।
अब देखते हैं कि वैज्ञानिक संकेतन में व्यक्त संख्याओं के साथ गणना कैसे की जाती है।
(i) गुणा और भाग को शामिल करने वाली गणना
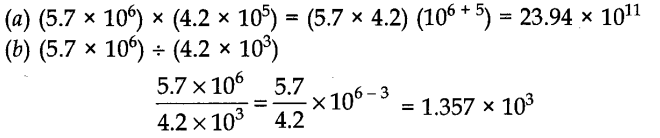
(ii) गणना जिसमें जोड़ और घटाना शामिल है: इन दो संक्रियाओं के लिए, पहली संख्या इस तरह लिखी जाती है कि उनका घातांक समान हो। उसके बाद, जैसा भी मामला हो, गुणांक जोड़े या घटाए जाते हैं। उदाहरण के लिए,
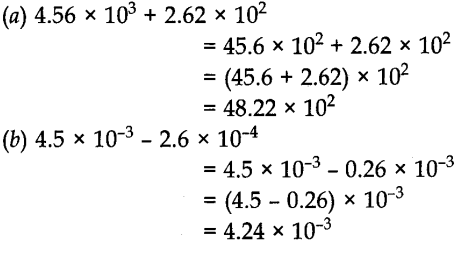
• महत्वपूर्ण – Class 11 Chemistry Chapter 1 Notes in Hindi PDF
अंक महत्वपूर्ण अंक सार्थक अंक होते हैं जिन्हें निश्चित रूप से जाना जाता है। सार्थक अंकों की संख्या निर्धारित करने के लिए कुछ नियम हैं। ये नीचे बताए गए हैं:
1. सभी गैर-शून्य अंक महत्वपूर्ण हैं। उदाहरण के लिए, 285 cm में, तीन सार्थक अंक हैं और 0.25 mL में, दो सार्थक अंक हैं।
2. पहले गैर-शून्य अंक से पहले के शून्य सार्थक नहीं होते हैं। ऐसे शून्य दशमलव बिंदु की स्थिति को इंगित करते हैं।
उदाहरण के लिए, 0.03 में एक सार्थक अंक है और 0.0052 में दो सार्थक अंक हैं।
3. दो शून्येतर अंकों के बीच के शून्य सार्थक होते हैं। इस प्रकार, 2.005 में चार सार्थक अंक हैं।
4. किसी संख्या के अंत या दाईं ओर स्थित शून्य सार्थक होते हैं बशर्ते वे दशमलव बिंदु के दाईं ओर हों। उदाहरण के लिए, 0.200 ग्राम में तीन महत्वपूर्ण आंकड़े हैं।
5. वस्तुओं की संख्या गिनना। उदाहरण के लिए, 2 गेंदों या 20 अंडों में अनंत महत्वपूर्ण अंक होते हैं क्योंकि ये सटीक संख्याएं हैं और दशमलव रखने के बाद अनंत संख्या में शून्य लिखकर इन्हें दर्शाया जा सकता है।
यानी, 2 = 2.000000
या 20 = 20.000000 • महत्वपूर्ण अंकों का
जोड़ और घटाव
अलग-अलग परिशुद्धता वाली संख्याओं के अतिरिक्त या घटाव के लिए, अंतिम परिणाम को दशमलव स्थानों की समान संख्या में सूचित किया जाना चाहिए, जिसमें दशमलव स्थानों की संख्या सबसे कम है।
उदाहरण के लिए, आइए हम तीन संख्याओं 3.52, 2.3 और 6.24 का योग करते हैं, जिनमें भिन्न-भिन्न परिशुद्धताएँ या दशमलव स्थानों की भिन्न-भिन्न संख्याएँ होती हैं।
अंतिम परिणाम में दो दशमलव स्थान होते हैं लेकिन उत्तर को केवल एक दशमलव स्थान तक ही सूचित करना होता है, अर्थात उत्तर 12.0 होगा।
संख्याओं का घटाव उसी तरह किया जा सकता है जैसे जोड़।

अंतिम परिणाम में चार दशमलव स्थान हैं। लेकिन इसे केवल दो दशमलव स्थानों तक ही रिपोर्ट करना होगा, यानी उत्तर 11.36 होगा।
• महत्वपूर्ण अंकों का गुणा और भाग
गुणा या भाग में, अंतिम परिणाम को उतनी ही महत्वपूर्ण संख्या तक सूचित किया जाना चाहिए जितना कि कम से कम सटीक संख्या में मौजूद है।
संख्याओं का गुणन: २.२१२० x ०.०११ = ०.०२४३३२
नियम के अनुसार अंतिम परिणाम = ०.०२४
संख्याओं का विभाजन: ४.२२११÷३.७६ = १.१२२६३
सही उत्तर = १.१२
• आयामी विश्लेषण
अक्सर गणना करते समय, इकाइयों को एक प्रणाली से एक प्रणाली में परिवर्तित करने की आवश्यकता होती है। अन्य। इसे पूरा करने के लिए इस्तेमाल की जाने वाली विधि को कारक लेबल विधि या इकाई कारक विधि या आयामी विश्लेषण कहा जाता है।
• रासायनिक संयोजनों के नियम
यौगिकों के निर्माण के लिए तत्वों का संयोजन निम्नलिखित पांच बुनियादी कानूनों द्वारा नियंत्रित होता है।
(i) द्रव्यमान के संरक्षण का नियम
(ii) निश्चित अनुपात का कानून
(iii) एकाधिक अनुपात का कानून
(iv) गैसीय मात्रा का कानून (समलैंगिक लुसाक का कानून)
(v) अवोगाद्रो का कानून
(i) द्रव्यमान के संरक्षण का
कानून कानून की स्थापना एक फ्रांसीसी रसायनज्ञ ए द्वारा की गई थी। लवॉज़ियर। कानून कहता है:
सभी भौतिक और रासायनिक परिवर्तनों में, अभिकारकों का कुल द्रव्यमान उत्पादों के बराबर होता है।
दूसरे शब्दों में, पदार्थ को न तो बनाया जा सकता है और न ही नष्ट किया जा सकता है।
निम्नलिखित प्रयोग इस कानून की सच्चाई को दर्शाते हैं।
(ए) जब पदार्थ भौतिक परिवर्तन से गुजरता है।
यह पाया गया है कि शारीरिक परिवर्तन होने के बावजूद वजन में कोई परिवर्तन नहीं हुआ है।
(बी) जब पदार्थ रासायनिक परिवर्तन से गुजरता है।
उदाहरण के लिए, मरक्यूरिक ऑक्साइड का अपघटन।
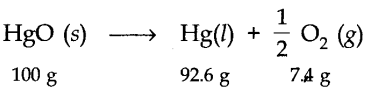
उपरोक्त अपघटन प्रतिक्रिया के दौरान, पदार्थ न तो प्राप्त होता है और न ही खोता है।
(ii) निश्चित अनुपात का
नियम इस नियम के अनुसार:
एक शुद्ध रासायनिक यौगिक में हमेशा वही तत्व होते हैं जो वजन के एक निश्चित अनुपात में एक साथ संयुक्त होते हैं।
उदाहरण के लिए, कार्बन डाइऑक्साइड कई तरीकों से बनाई जा सकती है,

(iii) एकाधिक अनुपात का नियम
यदि दो तत्व मिलकर दो या दो से अधिक यौगिक बनाते हैं, तो एक तत्व का वजन दूसरे के निश्चित वजन के साथ मिलकर बनता है। ये यौगिक भार के अनुसार सरल पूर्ण संख्या अनुपात धारण करते हैं।
उदाहरण के लिए,
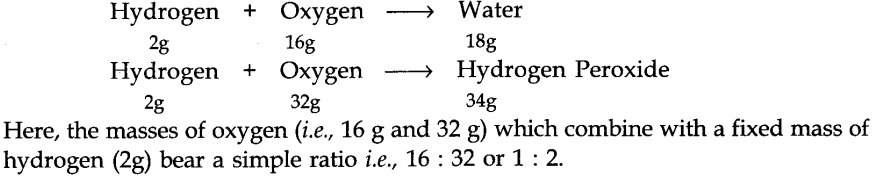
(iv) गे लुसैक का गैसीय आयतन का नियम
कानून कहता है कि, तापमान और दबाव की समान परिस्थितियों में, जब भी गैसें मिलती हैं, तो वे ऐसा वॉल्यूम में करती हैं जो एक दूसरे के साथ सरल पूर्ण संख्या अनुपात और गैसीय उत्पादों के साथ भी होते हैं। कानून को निम्नलिखित उदाहरणों से स्पष्ट किया जा सकता है।
(ए) हाइड्रोजन और क्लोरीन के बीच संयोजन:
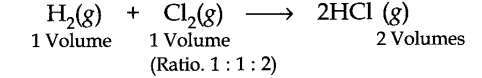
(बी) नाइट्रोजन और हाइड्रोजन के बीच संयोजन: दो गैसें उपयुक्त परिस्थितियों में अमोनिया गैस का निर्माण करती हैं। रासायनिक समीकरण
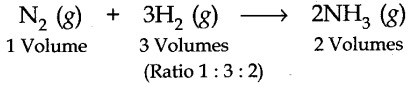
(v) अवोगाद्रो का नियम है: अवोगाद्रो ने प्रस्तावित किया कि समान तापमान और दबाव पर समान मात्रा में गैसों में समान संख्या में अणु होने चाहिए।
उदाहरण के लिए,
यदि हम पानी के उत्पादन के लिए हाइड्रोजन और ऑक्सीजन की प्रतिक्रिया पर विचार करते हैं, तो हम देखते हैं कि हाइड्रोजन के दो खंड ऑक्सीजन के एक आयतन के साथ मिलकर बिना किसी प्रतिक्रिया के बिना ऑक्सीजन छोड़े दो मात्रा में पानी देते हैं।
• डाल्टन का परमाणु सिद्धांत
1808 में, डाल्टन ने ‘ए न्यू सिस्टम ऑफ केमिकल फिलॉसफी’ प्रकाशित किया जिसमें उन्होंने निम्नलिखित प्रस्ताव
रखे : 1. पदार्थ में अविभाज्य परमाणु होते हैं।
2. किसी दिए गए तत्व के सभी परमाणुओं में समान द्रव्यमान सहित समान गुण होते हैं। विभिन्न तत्वों के परमाणु द्रव्यमान में भिन्न होते हैं।
3. यौगिक तब बनते हैं जब विभिन्न तत्वों के परमाणु एक निश्चित अनुपात में संयोजित होते हैं।
4. रासायनिक प्रतिक्रियाओं में परमाणुओं का पुनर्गठन शामिल है। ये रासायनिक अभिक्रिया में न तो बनते हैं और न ही नष्ट होते हैं।
• परमाणु भार
किसी तत्व का परमाणु द्रव्यमान उस तत्व के परमाणु से 12 गुना भारी होता है। यह ध्यान दिया जा सकता है कि ऊपर प्राप्त परमाणु द्रव्यमान सापेक्ष परमाणु द्रव्यमान हैं, न कि वास्तविक द्रव्यमान परमाणु।
एक परमाणु द्रव्यमान इकाई (amu) कार्बन-12 समस्थानिक के एक परमाणु के द्रव्यमान के l/12वें भाग के बराबर होती है। इसे एकीकृत द्रव्यमान के रूप में भी जाना जाता है।
औसत परमाणु द्रव्यमान
अधिकांश तत्व समस्थानिक के रूप में मौजूद होते हैं जो एक ही तत्व के अलग-अलग द्रव्यमान संख्या और समान परमाणु संख्या वाले अलग-अलग परमाणु होते हैं। इसलिए, किसी तत्व का परमाणु द्रव्यमान उसका औसत परमाणु द्रव्यमान होना चाहिए और इसे 12w के रूप में लिए गए कार्बन परमाणुओं (C-12) के द्रव्यमान की तुलना में किसी तत्व के परमाणु के औसत सापेक्ष द्रव्यमान के रूप में परिभाषित किया जा सकता है।
मॉलिक्यूलर मास्स
आणविक द्रव्यमान एक अणु में मौजूद तत्वों के परमाणु द्रव्यमान का योग है। यह प्रत्येक तत्व के परमाणु द्रव्यमान को उसके परमाणुओं की संख्या से गुणा करके और उन्हें एक साथ जोड़कर प्राप्त किया जाता है।
उदाहरण के लिए,
मीथेन का आणविक द्रव्यमान (CH4)
= 12.011 u + 4 (1.008 u)
= 16.043 u
सूत्र द्रव्यमान
आयनिक यौगिक जैसे NaCl, KNO 3 , Na 2 C0 3 आदि में अणु नहीं होते हैं, अर्थात एकल निकाय होते हैं लेकिन मौजूद होते हैं “जैसा कि चित्र में दिखाया गया है कि आयन तीन आयामी अंतरिक्ष में एक साथ मिलकर पैक होते हैं। 1.5.
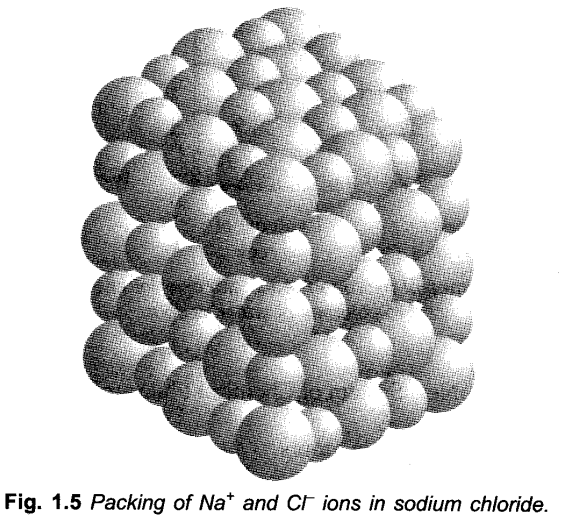
ऐसे मामलों में, आणविक द्रव्यमान के बजाय सूत्र द्रव्यमान की गणना करने के लिए सूत्र का उपयोग किया जाता है। अत: NaCl का सूत्र द्रव्यमान = सोडियम का परमाणु द्रव्यमान + क्लोरीन का परमाणु द्रव्यमान
= 23.0 यू + 35.5 यू = 58.5 यू।
• मोल अवधारणा
यह पाया गया है कि किसी भी तत्व के एक ग्राम परमाणु में परमाणुओं की संख्या समान होती है और किसी भी पदार्थ के एक ग्राम अणु में अणुओं की संख्या समान होती है। इस संख्या को प्रयोगात्मक रूप से निर्धारित किया गया है और 6.022137 x 10 23 के बराबर पाया गया है , मान को आम तौर पर अवोगाद्रो की संख्या या अवोगाद्रो स्थिरांक कहा जाता है।
यह आमतौर पर एनए द्वारा दर्शाया जाता है:
एवोगैड्रो की संख्या, एनए = 6.022 × 10 23
• प्रतिशत संरचना
कोई इस डेटा का विश्लेषण करके किसी दिए गए नमूने की शुद्धता की जांच कर सकता है। हमें पानी के उदाहरण (एच लेने से समझने की कोशिश करें 2 0)। चूंकि पानी में हाइड्रोजन और ऑक्सीजन होते हैं, इसलिए इन दोनों तत्वों की प्रतिशत संरचना की गणना निम्नानुसार की जा सकती है:
• अनुभवजन्य सूत्र
यौगिक का वह सूत्र जो यौगिक के एक अणु में उपस्थित विभिन्न तत्वों के परमाणुओं का सरलतम पूर्ण संख्या अनुपात देता है।
उदाहरण के लिए, हाइड्रोजन पेरोक्साइड का सूत्र एच 2 0 2 है । इसके अनुभवजन्य सूत्र को व्यक्त करने के लिए, हमें एक उभयनिष्ठ गुणनखंड 2 निकालना होगा। परमाणुओं का सरलतम पूर्ण संख्या अनुपात 1:1 है और अनुभवजन्य सूत्र HO है। इसी प्रकार ग्लूकोज का सूत्र C 6 H 12 0 6 है । परमाणुओं की सरलतम पूर्ण संख्या प्राप्त करने के लिए,
उभयनिष्ठ गुणनखंड = 6
अनुपात = 1 : 2 : 1 है ग्लूकोज का आनुभविक सूत्र = सीएच 2 0
• आण्विक सूत्र
यौगिक का वह सूत्र जो यौगिक के एक अणु में उपस्थित विभिन्न तत्वों के परमाणुओं का वास्तविक अनुपात बताता है।
उदाहरण के लिए, हाइड्रोजन पेरोक्साइड का आणविक सूत्र = एच 2 0 2 और ग्लूकोज = सी 6 एच 12 0 6
आण्विक सूत्र = एनएक्स अनुभवजन्य सूत्र
जहां एन सामान्य कारक है और इसे गुणा कारक भी कहा जाता है। n का मान १, २, ३, ४, ५, ६ आदि हो सकता है
। मामले में n १ है, एक यौगिक का आणविक सूत्र = यौगिक का अनुभवजन्य सूत्र।
• Stoichiometry और Stoichiometric गणना
शब्द ‘स्टोइकोमेट्री’ दो ग्रीक शब्दों- स्टोइचियन (अर्थ तत्व) और मेट्रोन (अर्थ माप) से बना है। स्टोइकोमेट्री, इस प्रकार अभिकारकों और रासायनिक प्रतिक्रिया में शामिल उत्पादों के द्रव्यमान (कभी-कभी आयतन भी) की गणना से संबंधित है। आइए मीथेन के दहन पर विचार करें। इस प्रतिक्रिया के लिए एक संतुलित समीकरण नीचे दिया गया है:
सीमित
अभिकारक /अभिकर्मक कभी-कभी, रासायनिक समीकरण में, उपस्थित अभिकारक संतुलित समीकरण के अनुसार आवश्यक मात्रा में नहीं होते हैं। तब बनने वाले उत्पादों की मात्रा उस अभिकारक पर निर्भर करती है जिसने पूरी तरह से प्रतिक्रिया की है। यह अभिकारक जो अभिक्रिया में पूर्णतया अभिक्रिया करता है, सीमित अभिकारक या सीमित करने वाला अभिकर्मक कहलाता है। वह अभिकारक जो अभिक्रिया में पूर्ण रूप से उपभोग नहीं करता है, आधिक्य अभिकारक कहलाता है।
समाधान में प्रतिक्रियाओं
जब प्रतिक्रियाओं समाधान में किया जाता है, इसके निश्चित मात्रा में पदार्थ की मात्रा निम्न तरीकों में से किसी में व्यक्त किया जा सकता:
1. जन प्रतिशत या वजन प्रतिशत (w / w%)
2. तिल अंश
3। मोलरिटी
4. मोललिटी
1. द्रव्यमान प्रतिशत: यह निम्नलिखित संबंध का उपयोग करके प्राप्त किया
जाता है : 2. मोल अंश: यह किसी विशेष घटक के मोलों की संख्या और घोल के मोलों की कुल संख्या का अनुपात है। विलायक के n1 मोल में घुले हुए n2 मोल वाले घोल के लिए,
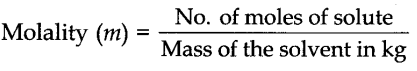
3. मोलरिटी: इसे 1 लीटर घोल में विलेय के मोल की संख्या के रूप में परिभाषित किया जाता है।
4. मोललिटी:इसे 1 किग्रा विलायक में उपस्थित विलेय के मोलों की संख्या के रूप में परिभाषित किया जाता है। इसे एम द्वारा निरूपित किया जाता है।
• सभी पदार्थों में पदार्थ होते हैं जो तीन अवस्थाओं – ठोस, तरल या गैस में मौजूद हो सकते हैं।
• पदार्थ को तत्वों, यौगिकों और मिश्रणों में भी वर्गीकृत किया जा सकता है।
• तत्व: एक तत्व में केवल एक ही प्रकार के कण होते हैं जो परमाणु या अणु हो सकते हैं।
• यौगिक तब बनते हैं जब दो या दो से अधिक तत्वों के परमाणु एक दूसरे से एक निश्चित अनुपात में जुड़ते हैं।
• मिश्रण: हमारे आस-पास मौजूद कई पदार्थ मिश्रण होते हैं।
• वैज्ञानिक संकेतन: रसायन शास्त्र में मात्राओं का मापन 10 -31 से 10 23 की एक विस्तृत श्रृंखला में फैला हुआ है । इसलिए, वैज्ञानिक संकेतन में संख्या को व्यक्त करने की एक सुविधाजनक प्रणाली का उपयोग किया जाता है।
• वैज्ञानिक आंकड़े: उन महत्वपूर्ण आंकड़ों की संख्या को निर्दिष्ट करके अनिश्चितता का ध्यान रखा जाता है जिनमें टिप्पणियों की सूचना दी जाती है।
• आयामी विश्लेषण: यह मापी गई मात्राओं को इकाइयों की विभिन्न प्रणालियों में व्यक्त करने में मदद करता है।
• रासायनिक संयोजन के नियम हैं:
(i) द्रव्यमान के संरक्षण का नियम
(ii) निश्चित अनुपात का कानून
(iii) एकाधिक अनुपात का कानून
(iv) गे लुसाक का गैसीय वॉल्यूम का नियम
(v) अवोगैड्रो का नियम।
• परमाणु द्रव्यमान: किसी तत्व का परमाणु द्रव्यमान कार्बन के 12C समस्थानिक के सापेक्ष व्यक्त किया जाता है जिसका सटीक मान 12u होता है।
• औसत परमाणु द्रव्यमान: उस तत्व के विभिन्न समस्थानिकों की प्राकृतिक प्रचुरता को ध्यान में रखकर प्राप्त किया जाता है।
• आण्विक द्रव्यमान: एक अणु का आणविक द्रव्यमान एक अणु में मौजूद विभिन्न परमाणुओं के परमाणु द्रव्यमान का योग लेकर प्राप्त किया जाता है।
• अवोगैड्रो संख्या: किसी दिए गए सिस्टम में मौजूद परमाणुओं, अणुओं या किसी भी अन्य कणों की संख्या को अवोगैड्रो स्थिरांक के रूप में व्यक्त किया जाता है।
= 6.022 x 10 23
• संतुलित रासायनिक समीकरण: एक संतुलित समीकरण में समीकरण के दोनों ओर प्रत्येक तत्व के परमाणुओं की संख्या समान होती है।
• Stoichiometry: आवश्यक अभिकारकों या बनने वाले उत्पादों के मात्रात्मक अध्ययन को Stoichiometry कहा जाता है। स्टोइकोमेट्रिक गणनाओं का उपयोग करते हुए, एक विशेष मात्रा में उत्पाद का उत्पादन करने के लिए आवश्यक एक या अधिक अभिकारकों की मात्रा निर्धारित की जा सकती है और इसके विपरीत।
Class 11 Chemistry Chapter 1 Notes Key Features
- आसान भाषा और आकर्षक स्वरूपण।
- विषय New Exam Pattern के अनुसार हैं ताकि छात्र Class 11 Chemistry Chapter 1 Notes को न्यूनतम समय में अधिकतम सटीकता के साथ पढ सकें।
- NCERT कक्षा 11 रसायन विज्ञान अध्याय 1 रसायन विज्ञान नोट्स की कुछ के दिशानिर्देशों के अनुसार हैं।
- Class 11 Chemistry Chapter 1 Notes से छात्रों को भारी किताबों से नहीं घबराना पडेगा।
- Class 11 Chemistry Chapter 1 Notes की कुछ बुनियादी अवधारणाएं अध्याय में प्रस्तुत सभी आवश्यक सूत्रों और अवधारणाओं को शामिल करती हैं।
- तनावपूर्ण परीक्षा के दिनों में ये नोट्स निश्चित रूप से आपका समय बचाएंगे।

